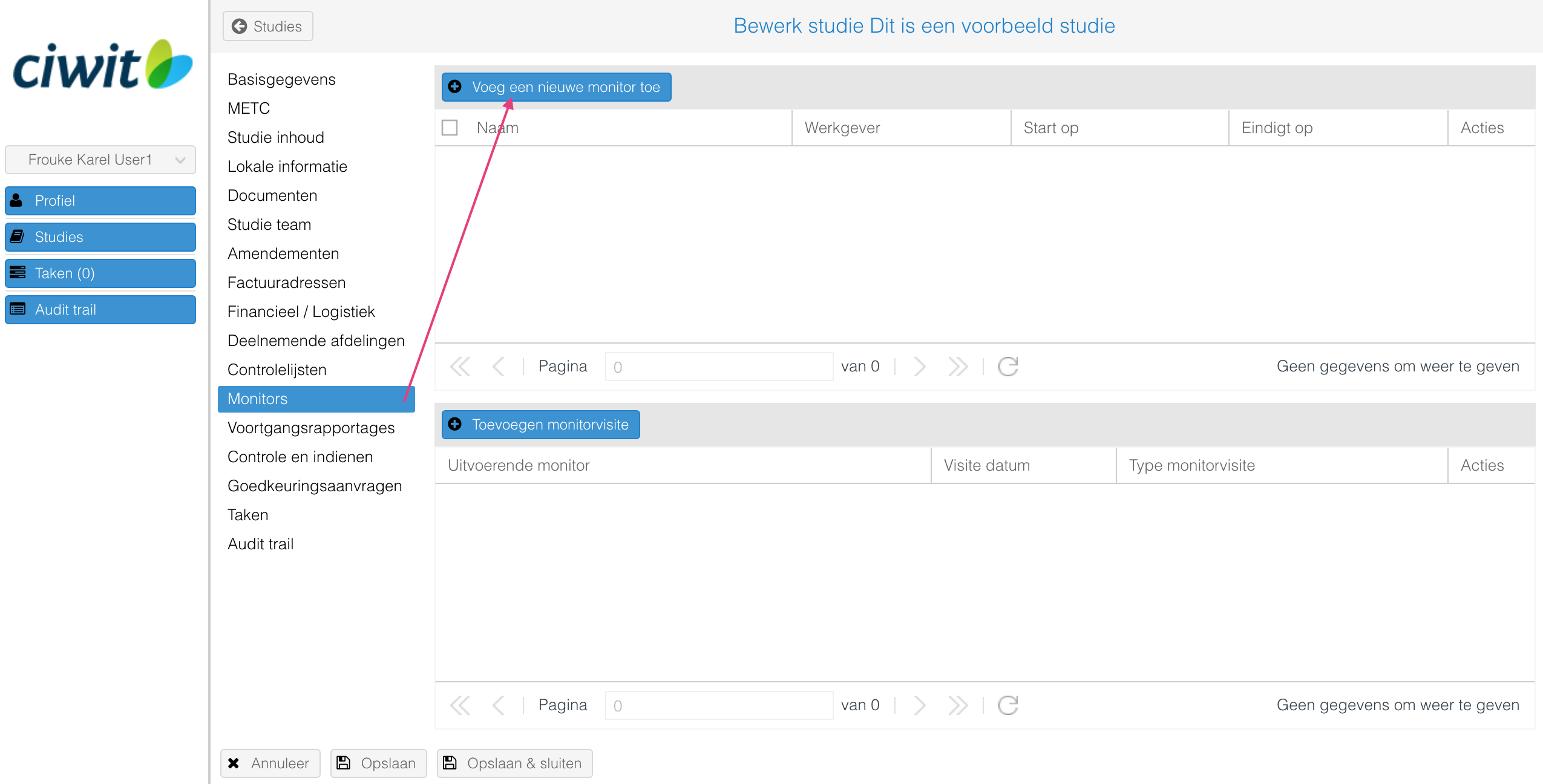
Het toevoegen van monitors en monitorvisites
Het tabblad "Monitors" biedt een overzicht van de monitors en de monitorvisites. Middels de start- en stopdatum van de monitor wordt inzichtelijk wanneer de monitor toegang dient te krijgen in het EPD.
Dit tabblad wordt alleen getoond bij WMO-plichtige studies.
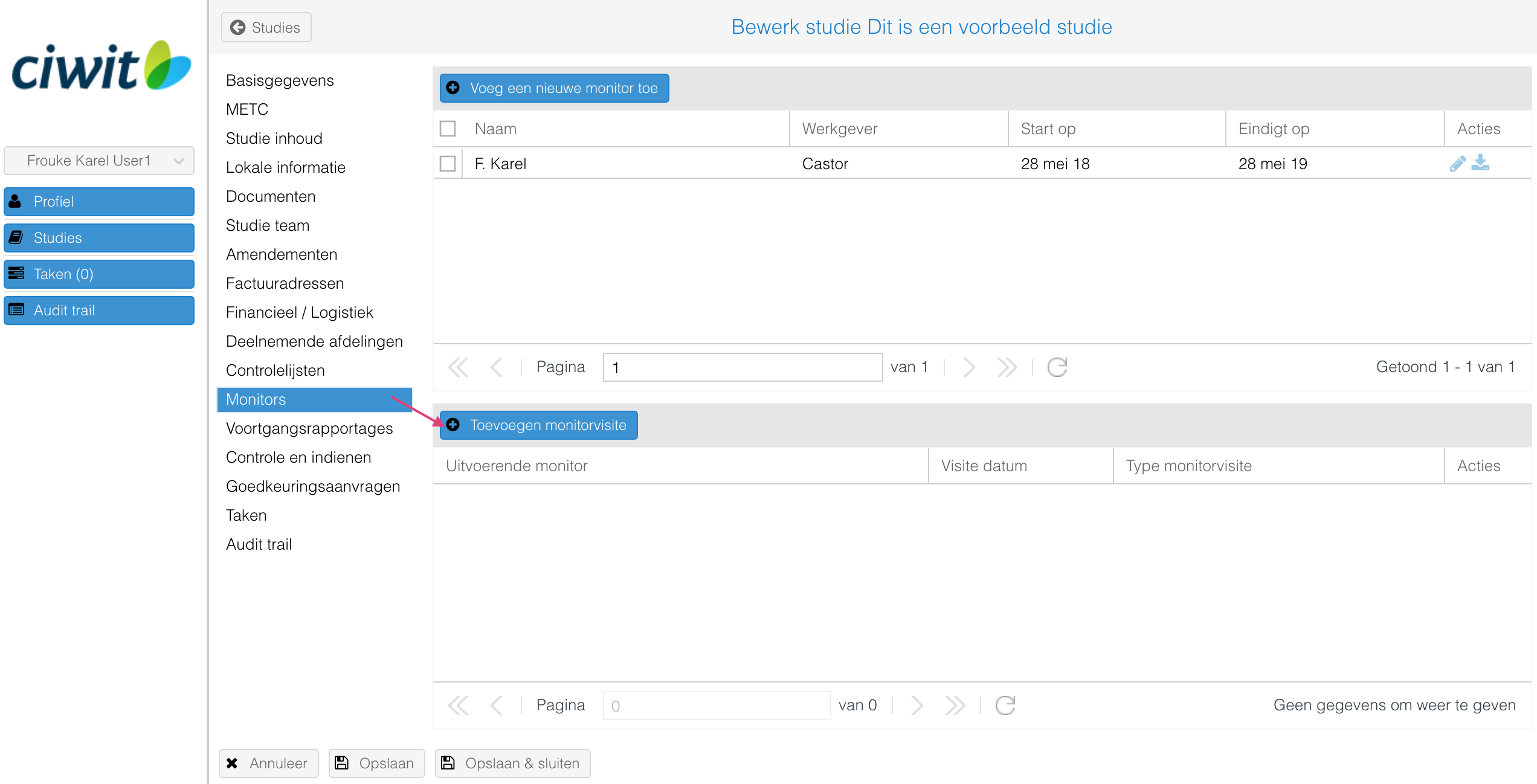
Het toevoegen van een monitor:
- Klik op de knop "Voeg een nieuwe monitor toe".
- Vul de gegevens aan en klik op "Opslaan" om de monitor toe te voegen.
De documenten die hier toegevoegd worden worden in het "Documenten" tabblad weergegeven.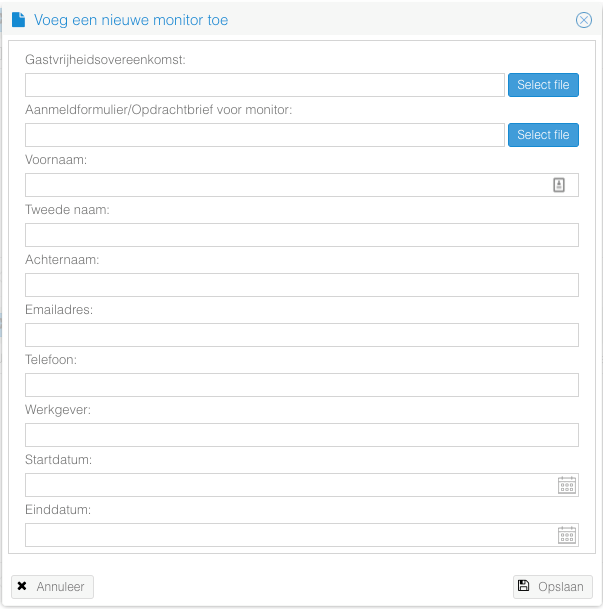
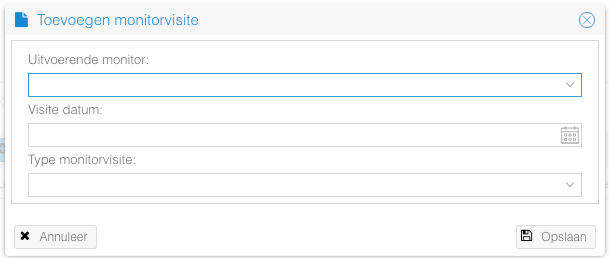
Het toevoegen van een monitorvisite:
Het is alleen mogelijk om een monitorvisite toe te voegen als er een monitor is toegevoegd aan de studie.
- Klik op de "Toevoegen monitorvisite" knop.
- Vul de gegevens aan en klik op "Opslaan" om de monitorvisite toe te voegen.